Ley de Dalton y el sistema respitarorio
“La
presión total de una mezcla de gases es la suma de las presiones parciales de
cada gas en la mezcla; sólo es cierto para los gases ideales.”
La ley de Dalton establece que
la presión total ejercida por la mezcla de gases inertes (no reactivos) es
igual a la suma de las presiones parciales de los gases individuales en un
volumen de aire.
El aire en la atmósfera es una
mezcla de muchos gases diferentes, que varían en concentración. La ley de
Dalton establece que, en un momento dado, el porcentaje de cada uno de estos
gases en el aire que respiramos hace su contribución a la presión atmosférica
total, y esta contribución dependerá de la cantidad de cada gas que esté en el
aire que respiramos.
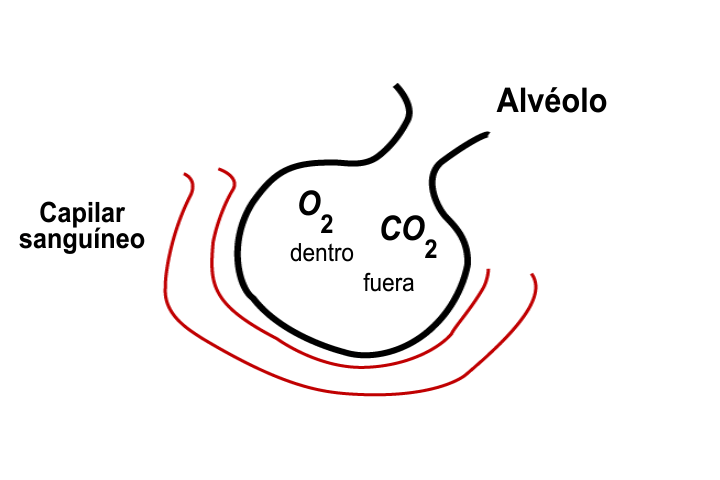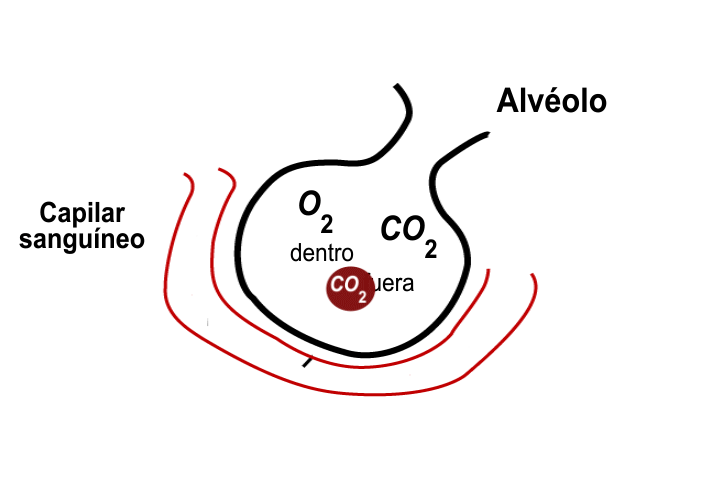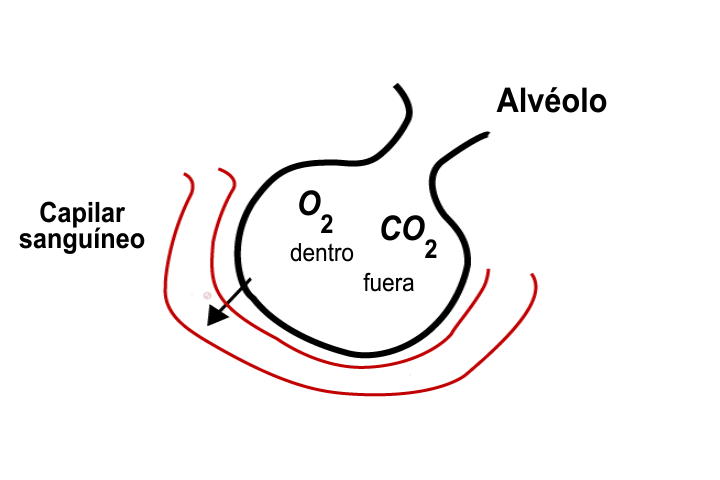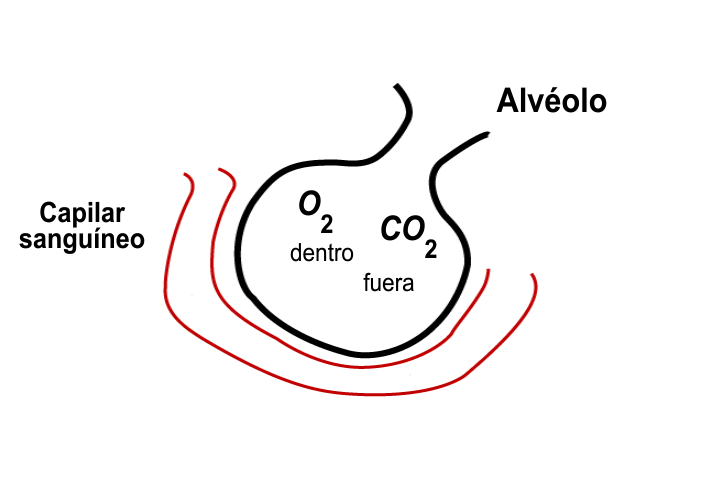
La ley de Dalton también implica que la concentración relativa de gases (sus presiones parciales) no cambia a medida que cambia la presión y el volumen de la mezcla de gases, por lo que el aire inhalado a los pulmones tendrá la misma concentración relativa de gases que el aire atmosférico. En los pulmones, la concentración relativa de gases determina la velocidad a la que cada gas se difundirá a través de las membranas alveolares, la presión de una mezcla de gases puede definirse como la suma de las presiones parciales de cada uno de los gases en el aire.
No hay comentarios.:
Publicar un comentario